2025.10.16
在血管生物学和再生医学研究中,人脐静脉内皮细胞(HUVEC)无疑是明星细胞模型,它们广泛应用于血管生成、药物筛选及免疫调控等领域。然而,代次选择(passage number) 往往会成为实验成败的关键变量。高代次细胞容易失去原始功能特性,导致数据偏差;低代次细胞则维持更稳定的分子表达和功能活性,确保结果可重复。研究表明,代次选择显著影响HUVEC的血管生成能力、屏障功能和细胞行为[1]。例如,EVs的血管诱导潜力随代次升高而降低[1][2],甚至影响细胞间互作模型的可重现性[3]。作为您专业的 HUVEC 供应伙伴,我们深知这些挑战,今天就带大家深入探讨HUVEC的核心实验应用、代次选择策略和实操技巧,助力您的实验效率飙升!
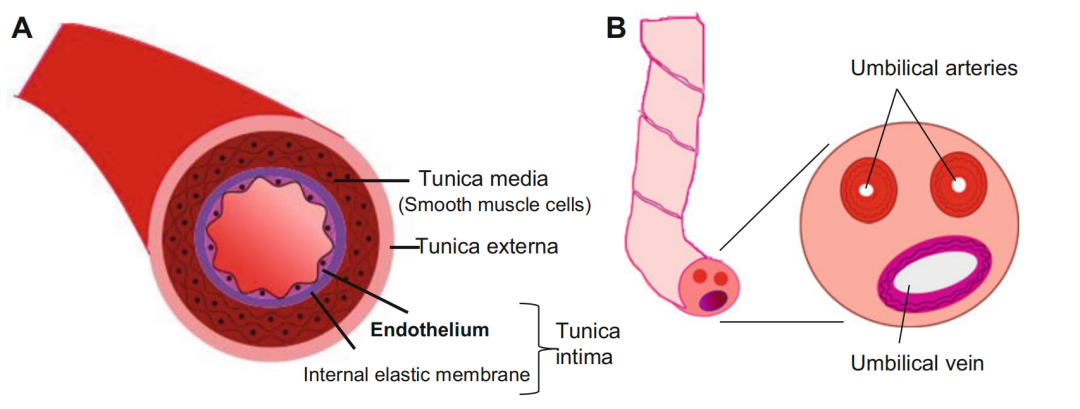
HUVEC在体外传代过程中,会发生表型漂变:高代次细胞(如P10+)可能出现衰老迹象、基因表达失调或功能退化,影响实验可靠性;而低代次细胞(如P3-P6)保留了更强的新生血管、屏障和迁移活性,减少变异风险。权威文献指出,代次差异会显著改变EVs对M2巨噬细胞基因表达的调控,甚至影响血管生成模型的稳定性[1][2]。例如,一项研究发现,Immortalized HUVEC与成纤维细胞共培养时,仅早期代次(低passage)能形成功能性微血管网络,这与Thy1表达变化相关[3]。因此,合理选择代次不仅能提升数据质量,还能节省优化时间。
接下来,我们系统解析HUVEC在七大核心实验中的应用,涵盖实验步骤、关键指标、代次建议和文献背书。所有建议均基于高分文献,确保权威性和实操性。
我们聚焦于血管生成、屏障功能、细胞迁移、免疫调控等热点实验,结合简明步骤、检测指标和代次策略。文献支持包括各权威期刊引用来源,保证科学严谨性
重要性:研究血管新生机制(如癌症或伤口愈合),HUVEC是金标准模型。
简单实验步骤
①管形成实验:将HUVEC接种于Matrigel基质中(37°C, 5% CO2),4-24小时后观察毛细血管样网络形成[4][5][6]。
②斑马鱼模型:在体内验证时,注入HUVEC细胞,分析播散灶数量和转移距离[7]。
关键指标:管长、分支点数、血管密度;分子标志如VEGFA和ANG-1表达水平(例如,GPX4下调抑制血管生成[8])。
代次选择:推荐使用低代次(P3-P6),高代次可能导致血管形成能力下降。研究显示,EVs的血管诱导作用随代次升高而减弱,影响实验可重复性[1][2]]。
内皮屏障功能研究
重要性:评估血管通透性和药物渗透,与炎症性疾病紧密相关。
简单实验步骤
①Transwell实验:将HUVEC铺于transwell膜上,加入激动剂(如bradykinin)后,检测荧光物质透过率;或用免疫荧光观察屏障完整性[9][10]。
关键指标:内皮间隙形成、通透性指数;分子如S1P通路信号(S1P激动剂能保护屏障功能[9])。
代次选择:优选P4-P8,高代次屏障易损(如P>10时,黏附分子表达降低[11])。CU06-1004药物验证中,屏障响应随代次增加而异常[10]。
细胞迁移与伤口愈合
重要性:模拟伤口修复和癌细胞转移过程。
简单实验步骤:
①伤口愈合assay:在孔板中划出“伤口”,24-48小时后显微镜观察细胞迁移距离[12][13][14]。
②Transwell迁移:下室添加趋化因子,上室HUVEC迁移后染色定量[13][14]。
关键指标:迁移距离、伤口闭合率;迁移相关基因表达(如IL-28A通过eNOS/AKT促进迁移[13])。
代次选择:建议P3-P7,高代次细胞活力和响应性降低。研究证实,IL-28A处理早期代次HUVEC时迁移显著增强,passage增加削弱此效应[13][13]。
炎症与免疫调控
重要性:探索内皮细胞在免疫应答中的作用,如动脉粥样硬化或风湿病模型。
简单实验步骤:
①LPS刺激实验:加入脂多糖激活HUVEC,检测炎性因子分泌;或与巨噬细胞共培养,分析极化调控[1][15][16]。
关键指标:IL-6、TNF-α、M1/M2标志物水平;屏障调控分子如SOCS3表达(CM-EPS抑制炎症通路[15])。
代次选择:P4-P8为宜,高代次炎性响应易失敏。实验显示,低passage HUVEC在LPS刺激下维持稳定的M2基因表达[1]。
代谢与氧化应激
重要性:涉及铁死亡和ROS调控,应用于衰老与抗癌研究。
简单实验步骤:
①铁死亡模型:加GPX4抑制剂(如RSL3),检测细胞死亡;或测量葡萄糖/乳酸代谢产物[8][17][15]。
关键指标:ROS水平、铁死亡标志物(如GPX4降解);关键通路如VEGFA表达(氧化应激抑制血管生成[8][15])。
代次选择:低代次P3-P6(高代次抗氧化能力下降)。GPX4下调在早期代次HUVEC中更显著影响VEGFA和ANG-1[8]。
基因编辑与表观遗传
重要性:用于CRISPR编辑或表观修饰研究,验证靶点机制。
简单实验步骤:
①CRISPR编辑:转染sgRNA敲除基因(如EHD1或ERK1/2),通过WB或qPCR验证;或进行甲基化分析[18][19]。
关键指标:编辑效率、下游信号激活(如β2AR通路响应[18]);表观变化如甲基化谱[19]。
代次选择:严格使用P3-P6,高代次基因稳定性低。研究证明,代次增加导致甲基化异常,影响调控区域(如MYC motif),降低编辑可预测性[20][19]。
药物筛选与纳米毒性
重要性:评估新型纳米材料或抗血管药物安全性。
简单实验步骤:
①纳米颗粒测试:加入CeONPs或RNPs,48小时后检测细胞活性和血管形成;或用HUVEC进行高通量药物初筛[4][21][10]。
关键指标:细胞毒性、血管抑制率;分子标记如HIF-1α表达(氧化锌纳米颗粒抑制VEGF通路[4][21])。
代次选择:优选P4-P8,确保药物响应稳定(高代次易假阴性)。实验表明,RNPs对早期代次HUVEC的血管抑制效果更可靠[4]。
综合上述实验,低代次(P3-P6)是大多数研究的理想选择。早期传代细胞能维持高增殖力、屏障功能和分子表达一致性。权威文献强调,代次差异不仅影响单个实验(如血管生成能力[1]),还可能导致多实验室间数据不可复现(如MSCs血管诱导活性变异性[2])。实操中,我们建议:
HUVEC的精准应用,离不开科学的代次管理。通过本文的技术参考,您可以高效规划血管生成、药物筛选等实验,规避变异风险。代次选择不只是一种规范,更是提升数据可信度和创新性的关键!如果您想探索优化实验方案,欢迎随时交流——我们致力于提供高质量、批次稳定的细胞资源,助您在医学研究中乘风破浪!
1.Liu, Yuan et al. “Mesenchymal stromal/stem cell tissue source and in vitro expansion impact extracellular vesicle protein and miRNA compositions as well as angiogenic and immunomodulatory capacities.” Journal of extracellular vesicles vol. 13,8 (2024): e12472. doi:10.1002/jev2.12472
2.Lam, Johnny et al. “A microphysiological system-based potency bioassay for the functional quality assessment of mesenchymal stromal cells targeting vasculogenesis.” Biomaterials vol. 290 (2022): 121826. doi:10.1016/j.biomaterials.2022.121826
3.Wan, Zhengpeng et al. “A robust vasculogenic microfluidic model using human immortalized endothelial cells and Thy1 positive fibroblasts.” Biomaterials vol. 276 (2021): 121032. doi:10.1016/j.biomaterials.2021.121032
4.Shashni, Babita et al. “Management of tumor growth and angiogenesis in triple-negative breast cancer by using redox nanoparticles.” Biomaterials vol. 269 (2021): 120645. doi:10.1016/j.biomaterials.2020.120645
5.Li, Qian et al. “Oligohistidine and targeting peptide functionalized TAT-NLS for enhancing cellular uptake and promoting angiogenesis in vivo.” Journal of nanobiotechnology vol. 16,1 29. 26 Mar. 2018, doi:10.1186/s12951-018-0358-x
6.Li, Xiaoqun et al. “Hypoxia preconditioning of adipose stem cell-derived exosomes loaded in gelatin methacryloyl (GelMA) promote type H angiogenesis and osteoporotic fracture repair.” Journal of nanobiotechnology vol. 22,1 112. 15 Mar. 2024, doi:10.1186/s12951-024-02342-6
7.Zhang, Qi et al. “ACE2 inhibits breast cancer angiogenesis via suppressing the VEGFa/VEGFR2/ERK pathway.” Journal of experimental & clinical cancer research : CR vol. 38,1 173. 25 Apr. 2019, doi:10.1186/s13046-019-1156-5
8.Zhang, Ying et al. “BaP/BPDE suppressed endothelial cell angiogenesis to induce miscarriage by promoting MARCHF1/GPX4-mediated ferroptosis.” Environment international vol. 180 (2023): 108237. doi:10.1016/j.envint.2023.108237
9.Burg, Nathalie et al. “Sphingosine 1-Phosphate Receptor 1 Signaling Maintains Endothelial Cell Barrier Function and Protects Against Immune Complex-Induced Vascular Injury.” Arthritis & rheumatology (Hoboken, N.J.) vol. 70,11 (2018): 1879-1889. doi:10.1002/art.40558
10.Lee, Sunghye et al. “CU06-1004 alleviates vascular hyperpermeability in a murine model of hereditary angioedema by protecting the endothelium.” Allergy vol. 78,5 (2023): 1333-1346. doi:10.1111/all.15674
11.Long, Dongping et al. “A single-cell analysis platform for electrochemiluminescent detection of platelets adhesion to endothelial cells based on Au@DL-ZnCQDs nanoprobes.” Biosensors & bioelectronics vol. 102 (2018): 553-559. doi:10.1016/j.bios.2017.11.058
12.Cheng, Hao-Wei et al. “Cancer cells increase endothelial cell tube formation and survival by activating the PI3K/Akt signalling pathway.” Journal of experimental & clinical cancer research : CR vol. 36,1 27. 7 Feb. 2017, doi:10.1186/s13046-017-0495-3
13.Song, Jun-Hui et al. “IL-28A/IL-10Rβ axis promotes angiogenesis via eNOS/AKT signaling and AP-1/NF-κB/MMP-2 network by regulating HSP70-1 expression.” Journal of advanced research, S2090-1232(24)00356-4. 9 Aug. 2024, doi:10.1016/j.jare.2024.08.013
14.Mi, Bobin et al. “Saliva exosomes-derived UBE2O mRNA promotes angiogenesis in cutaneous wounds by targeting SMAD6.” Journal of nanobiotechnology vol. 18,1 68. 6 May. 2020, doi:10.1186/s12951-020-00624-3
15.Zhao, Yihe et al. “Conditioned medium from contracting skeletal muscle cells reverses insulin resistance and dysfunction of endothelial cells.” Metabolism: clinical and experimental vol. 82 (2018): 36-46. doi:10.1016/j.metabol.2017.12.008
16.Luo, Qian et al. “Tsp-1+ microglia attenuate retinal neovascularization by maintaining the expression of Smad3 in endothelial cells through exosomes with decreased miR-27a-5p.” Theranostics vol. 13,11 3689-3706. 26 Jun. 2023, doi:10.7150/thno.84236
17.Deng, Fengliu et al. “Tumor-secreted dickkopf2 accelerates aerobic glycolysis and promotes angiogenesis in colorectal cancer.” Theranostics vol. 9,4 1001-1014. 30 Jan. 2019, doi:10.7150/thno.30056
18.Wang, Ting et al. “Mammalian Eps15 homology domain 1 potentiates angiogenesis of non-small cell lung cancer by regulating β2AR signaling.” Journal of experimental & clinical cancer research : CR vol. 38,1 174. 25 Apr. 2019, doi:10.1186/s13046-019-1162-7
19.Ricard, Nicolas et al. “Endothelial ERK1/2 signaling maintains integrity of the quiescent endothelium.” The Journal of experimental medicine vol. 216,8 (2019): 1874-1890. doi:10.1084/jem.20182151
20.Panopoulos, Athanasia D et al. “Aberrant DNA Methylation in Human iPSCs Associates with MYC-Binding Motifs in a Clone-Specific Manner Independent of Genetics.” Cell stem cell vol. 20,4 (2017): 505-517.e6. doi:10.1016/j.stem.2017.03.010
21.Badia, Anna et al. “Repeated Topical Administration of 3 nm Cerium Oxide Nanoparticles Reverts Disease Atrophic Phenotype and Arrests Neovascular Degeneration in AMD Mouse Models.” ACS nano, 10.1021/acsnano.2c05447. 3 Jan. 2023, doi:10.1021/acsnano.2c05447
22.Lu, Juan et al. “Exosomal miR-9 inhibits angiogenesis by targeting MDK and regulating PDK/AKT pathway in nasopharyngeal carcinoma.” Journal of experimental & clinical cancer research : CR vol. 37,1 147. 13 Jul. 2018, doi:10.1186/s13046-018-0814-3
23.Dai, Lei et al. “SARI inhibits angiogenesis and tumour growth of human colon cancer through directly targeting ceruloplasmin.” Nature communications vol. 7 11996. 29 Jun. 2016, doi:10.1038/ncomms11996
24.Chao, Chi-Chao et al. “Transthyretin variants impact blood-nerve barrier and neuroinflammation in amyloidotic neuropathy.” Brain : a journal of neurology, awaf028. 28 Jan. 2025, doi:10.1093/brain/awaf028
25.Wang, Yifan et al. “Mitochondria Transplantation to Bone Marrow Stromal Cells Promotes Angiogenesis During Bone Repair.” Advanced science (Weinheim, Baden-Wurttemberg, Germany) vol. 11,39 (2024): e2403201. doi:10.1002/advs.202403201
26.Coly, Pierre-Michaël et al. “Low fluid shear stress stimulates the uptake of noxious endothelial extracellular vesicles via MCAM and PECAM-1 cell adhesion molecules.” Journal of extracellular vesicles vol. 13,10 (2024): e12414. doi:10.1002/jev2.12414
27.Louro, Ana F et al. “Bioactivity and miRNome Profiling of Native Extracellular Vesicles in Human Induced Pluripotent Stem Cell-Cardiomyocyte Differentiation.” Advanced science (Weinheim, Baden-Wurttemberg, Germany) vol. 9,15 (2022): e2104296. doi:10.1002/advs.202104296
28.Xin, Jingxue et al. “Chromatin accessibility landscape and regulatory network of high-altitude hypoxia adaptation.” Nature communications vol. 11,1 4928. 1 Oct. 2020, doi:10.1038/s41467-020-18638-8
29.Mao, Yu et al. “Hypoxic exosomes facilitate angiogenesis and metastasis in esophageal squamous cell carcinoma through altering the phenotype and transcriptome of endothelial cells.” Journal of experimental & clinical cancer research : CR vol. 38,1 389. 5 Sep. 2019, doi:10.1186/s13046-019-1384-8
30.He, Yanwei et al. “SHED-derived exosome-mimetics promotes rotator cuff tendon-bone healing via macrophage immunomodulation through NF-κB suppression and autophagy activation.” Materials today. Bio vol. 34 102146. 28 Jul. 2025, doi:10.1016/j.mtbio.2025.102146
31.Ciccone, Valerio et al. “Stemness marker ALDH1A1 promotes tumor angiogenesis via retinoic acid/HIF-1α/VEGF signalling in MCF-7 breast cancer cells.” Journal of experimental & clinical cancer research : CR vol. 37,1 311. 12 Dec. 2018, doi:10.1186/s13046-018-0975-0
32.Silkenstedt, Elisabeth et al. “Notch1 signaling in NOTCH1-mutated mantle cell lymphoma depends on Delta-Like ligand 4 and is a potential target for specific antibody therapy.” Journal of experimental & clinical cancer research : CR vol. 38,1 446. 1 Nov. 2019, doi:10.1186/s13046-019-1458-7
33.Liu, Bo et al. “Exosomes derived from differentiated human ADMSC with the Schwann cell phenotype modulate peripheral nerve-related cellular functions.” Bioactive materials vol. 14 61-75. 14 Dec. 2021, doi:10.1016/j.bioactmat.2021.11.022
向下滑动,查看更多
妙顺(上海)生物科技有限公司成立于2014年,总部位于上海,目前在浙江、江苏、山东和深圳均设有子公司。公司以细胞为核心支点,提供优质的药物临床前研究模型和工具,解决国内生物医药“卡脖子”问题,为客户提供小分子药物、单/双抗、CAR-T等细胞药物、抗体偶联药物(ADC)、肿瘤疫苗等创新药从药物筛选、体外药效研究、动物体内药效评价、药代动力学研究到毒理学评价等一系列全方位的药物发现及药效评价解决方案。
公司一直秉持着QbD理念,致力于打造国际标准化质量管理体系,先后引进了GCP、GMP、GLP、ISO(ISO 9001:2015/ISO 14001:2015/ISO 45001:2018)质量管理体系规范,从人、机、料、法、环各个角度,以确保客户获得高质量的服务,合作客户超1200家,受到一致好评。
咨询热线:021-64169739
咨询邮箱:sales@miles-bio.com