
与您分享妙顺生物的重要时刻
2025.12.16
近日武汉大学化学与分子科学学院张先正教授团队在《Advanced Materials》上发表最新文章Senescence Reprogramming Unleashes Tumor Immune Surveillance via Coordinated Gene Modulation。
细胞衰老可通过衰老相关分泌表型(SASP)募集免疫细胞用于肿瘤治疗,但其疗效受限于免疫耐受及免疫抑制性肿瘤微环境(TME)。通过协同调控P16INK4a与PD-L1重编程肿瘤特异性衰老,可增强肿瘤免疫原性并缓解免疫抑制。
本项研究通过协同调控P16INK4a与PD-L1两个关键靶点,构建了一种创新的uPAR靶向基因递送纳米系统(TEPP),实现肿瘤特异性衰老重编程。该系统能够诱导肿瘤细胞发生SASP介导的免疫激活,同时解除PD-L1介导的免疫抑制,有效将“冷肿瘤”转化为“热肿瘤”。在多种临床前模型中,TEPP单用即能显著抑制肿瘤生长与转移,与免疫检查点抑制剂联用后疗效进一步提升。研究不仅揭示了衰老调控与免疫协同作用的新机制,也为肿瘤靶向递送和免疫治疗联合策略的开发提供了重要技术平台与理论依据。

英文题目: Senescence Reprogramming Unleashes Tumor Immune Surveillance via Coordinated Gene Modulation
本研究展现了诱导肿瘤特异性衰老重编程的临床潜力,以改善靶向基因递送并增强实体瘤的免疫治疗效果。并且提供了一个可适应多种联合治疗方案的模块化平台,如与溶瘤病毒或减毒沙门氏菌结合可进一步增强肿瘤选择性递送,而与过继细胞疗法(CAR-T、CAR- NK)联合使用可能产生持续且扩增的免疫反应。
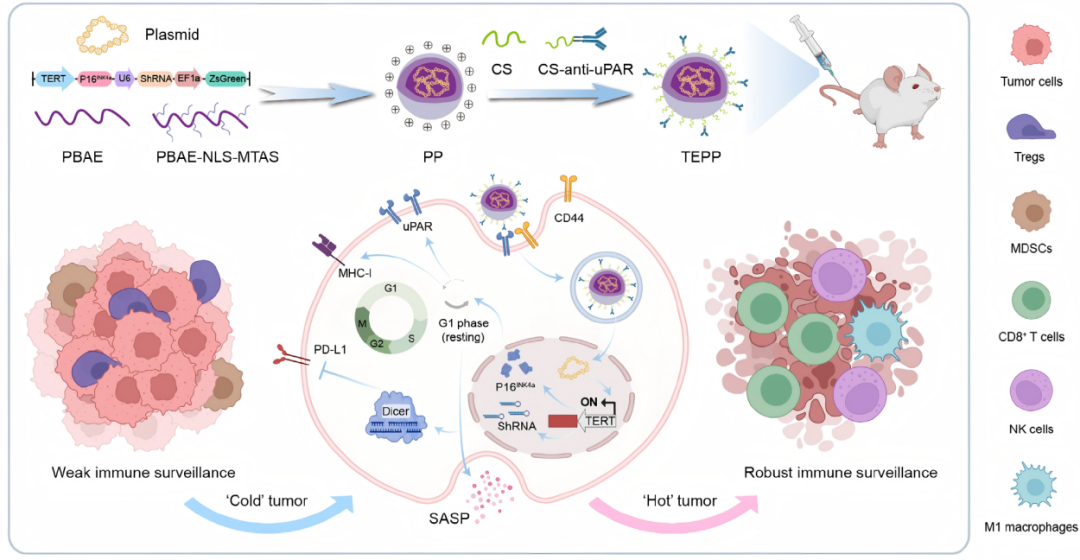
在本项研究中,科研人员采用凌生科技Kryogene系列的治疗用细胞冷冻保护剂,高效保存了激活后的OT-1 CD8⁺ T细胞,保障了后续细胞杀伤实验的可靠性,阐明了“通过TEPP纳米系统协同过表达P16INK4a与敲低PD-L1以增强肿瘤免疫监视”这一核心机制。




